Китайский ученый Цзянькуй Хэ в понедельник объявил, что первые в истории генно-модифицированные люди уже живут среди нас: речь идет рождении девочек-близнецов, у которых с помощью технологии CRISPR был искусственно изменен ген, отвечающий за восприимчивость к ВИЧ. В этой сенсационной истории пока много неясного.
В первую очередь, о самом эксперименте автор объявил не общепринятым способом — с помощью публикации в научном журнале, а в видеоролике(https://www.youtube.com/watch?v=th0vnOmFltc) на YouTube. Университет, где работал Цзянькуй Хэ, открестился от этого проекта, коллеги осудили экспериментатора, а китайские власти начали расследование. N + 1 попросил ученых рассказать, насколько реалистичной выглядит история, рассказанная китайским ученым, насколько доступен метод генной модификации человеческих эмбрионов, какие риски и опасности могут возникать в таких экспериментах, почему в большинстве западных стран такие эксперименты запрещены и можем ли мы в скором будущем ждать генно-модифицированных спортсменов, интеллектуалов или «служебных людей».
Что произошло?
Если очень коротко: Цзянькуй Хэ из Южного университета науки и технологий в Шэньчжэне отредактировал методом CRISPR/Cas9 зиготу, полученную в результате оплодотворения яйцеклетки матери сперматозоидом ВИЧ-инфицированного отца (с неопределяемым уровнем вирусной нагрузки), модифицировав в ней ген CCR5. Эта мутация делает человека маловосприимчивым к риску заражения ВИЧ. Затем эмбрион была подсажен матери с помощью стандартных методов, используемых при экстракорпоральном оплодотворении (ЭКО), и в результате родились девочки-близнецы — Лулу и Нана.
Хэ заявляет, что еще одна женщина сейчас беременна генно-модифицированным ребенком, а семь других пар участвуют в эксперименте, в настоящее время, впрочем, приостановленном «в связи с текущей ситуацией».
Что такое CRISPR-Cas
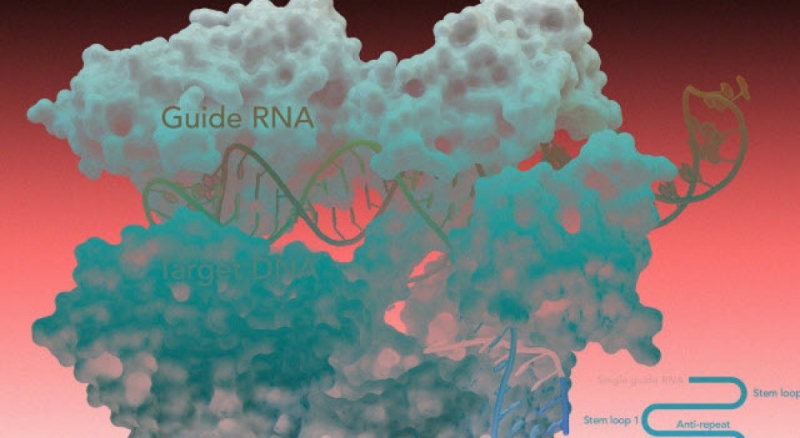
История систем CRISPR-Cas далека от человека — в природе они найдены у организмов, очень сильно отличающихся от нас: бактерий и архей. В этих сравнительно простых клетках CRISPR-Cas представляет собой аналог адаптивного иммунитета. Непосредственно CRISPR — это аббревиатура, описывающая участок бактериального генома, где записана информация о тех вирусах, с которыми встречались предки этой клетки. Эти данные хранятся в виде библиотеки коротких кусочков вирусной ДНК, которую бактерия получает по наследству и может пополнять самостоятельно.
Если бактерия сталкивается с вирусом, информация о котором записана в CRISPR-библиотеке, Cas-белки могут распознать и уничтожить «непрошенного гостя». Для этого необходимо представить данные из библиотеки в виде молекулы РНК. Комплекс Cas-РНК сканирует ДНК и ищет соответствия, а при совпадении — режет.
Причем же здесь генетические болезни человека? Ключевое здесь — умение Cas-белков резать ДНК в четко заданном участке. Идея заключается в следующем: вместо того, чтобы считывать РНК с CRISPR-библиотеки, ученые просто берут нужную короткую молекулу РНК (она называется гидовой, или направляющей), соответствующую определенному месту в геноме. В комплексе с белком Cas (из всего природного разнообразия CRISPR-Cas-систем для работы с животными клетками чаще всего используется белок Cas9 из стрептококка) направляющую РНК вводят в клетки. Там Cas9 находит нужный участок, например, содержащий мутацию, и вносит разрез.
Однако это еще не все. Чтобы исправить вредную мутацию, кроме комплекса белка Cas9 с РНК, в клетку нужно добавить еще «заплатку», содержащую нужную последовательность ДНК. Используя ее, системы репарации клетки «починят» порезанную ДНК и вместо мутации на этом месте появится другая, «нормальная» последовательность.
Нужно это не только и не столько для лечения.
Технология редактирования генома открывает новые горизонты для его исследователей. Возможность варьировать последовательность ДНК живых организмов существовала и раньше, но по сравнению с генно-инженерными методами, существовавшими до «эпохи CRISPR-Cas» (которая, к слову, началась всего шесть лет назад), предлагаемый механизм достаточно прост и эффективен. Он помогает быстро создавать модельные системы для самого разного класса задач, как из области фундаментальной генетики, так и в прикладной медицине, и уже стал своеобразным must have во многих биологических лабораториях.
Подробнее об этом методе можно прочесть в нашем материале «Запомните эти буквы»(https://nplus1.ru/material/2016/02/02/crisprfaq).
Почему в результатах Хэ сомневаются?
Сомнения возникли из-за того, в какой форме было объявлено о новом результате. Во-первых, Хэ не опубликовал свою работу в научном журнале, нарушив обычную процедуру для объявления о результатах экспериментов. Статью в журнале перед публикацией обычно читают и оценивают несколько рецензентов и редактор.
Вместо этого Хэ записал ролик на YouTube, в котором объявил не только об успехе, но и о том, что родившихся девочек увидеть нельзя, а данные об их семье засекречены. Масла в огонь добавил Южный университет, где формально числится ученый, — там заявили, что он уже полгода находится в неоплачиваемом отпуске и об этой работе им ничего неизвестно.
Во-вторых, есть и сомнения более общего рода: почему, задается вопросом известный научный журналист Леонид Шнайдер, для столь эпохального эксперимента был выбран именно ВИЧ, а не какая-нибудь врожденная смертельная генетическая болезнь?
Со Шнайдером солидарен и Пауль Калиниченко — профессор Московского государственного юридического университета имени Кутафина (МГЮА), исследующий мировые практики законодательного регулирования генетических экспериментов. «Это очень странный пример. ВИЧ — это не генетическое заболевание, то есть при редактировании генома происходит не лечение, а лишь снижение риска заражения. Зато ВИЧ — заболевание очень известное. Потому что пороки сердца или гемофилия — редкие, они не так будоражат людей, многие о них вообще не слышали. С ними сенсации не создать, а с ВИЧ — можно, это пандемия, некая трибуна. Я из-за этого и усомнился в достоверности [заявлений Хэ]», — говорит Калиниченко.
А рождение генно-модифицированных людей вообще возможно?
Да, вполне — и с практической возможностью подобной работы согласны большинство экспертов. Более того, Хэ находится в одном из лучших мест для проведения таких исследований.
«Проверить сказанное сложно, но, оценивая гипотетическую возможность, мы можем опираться на историю предыдущих лет. И мы знаем, что первыми геном эмбриона человека отредактировали именно китайские ученые — этот эксперимент был проведен еще в 2015 году (правда не слишком успешно). Там речь шла о нежизнеспособных зиготах, то есть эмбрион не подсаживали матери. Годом позднее наш знаменитый соотечественник Шухрат Миталипов, работающий сейчас в Университете здоровья и наук Орегона, развил и закрепил этот опыт», — рассказывает Павел Волчков, заведующий лабораторией геномной инженерии Московского физико-технического института (МФТИ).
Миталипов по всем канонам опубликовал свою статью в Nature. В ней доказывается возможность редактирования генома человека на стадии эмбриона с целью избежать проявления генетического заболевания — гипертрофической кардиомиопатии, для которой сегодня существует только симптоматическое лечение. Препарат, редактирующий ген, вводили в зиготу — эмбрион на стадии его одноклеточного развития. Затем зиготе давали развиться до бластоцисты — первой многоклеточной стадии. Путем анализа генома клеток было показано, что редактирование состоялось. На этом эксперимент прервался.
«Как видно, все основополагающие работы были сделаны, оставалось только подсадить эту бластоцисту обратно матери — то есть проделать совершенно рутинную операцию, обычную при ЭКО, которым пользуются женщины, допустим, с непроходимостью маточных труб. Почему ранее эксперимент всегда прерывали? Чтобы не проводить незаконный эксперимент на человеке. Дело в том, что эксперименты на эмбрионах законны, так как в разных странах его до определенного возраста человеком не считают. Вот до этого оговоренного в законе возраста и доращивали многоклеточную стадию», — поясняет Волчков..
Насколько это сложно?
Судя по всему, вывести генно-модифицированных людей не очень сложно — конечно, в условиях современной лаборатории, занимающейся редактированием генома и, желательно, работающей при большой репродуктивной клинике.
«Технология микроинъекции в оплодотворенную зиготу, с помощью которой проводится редактирование генома, — это несложно, — говорит Павел Волчков. — А Хэ работал в лаборатории, где делают ЭКО. В такой лаборатории всегда под руками имеется большое количество оплодотворенных яйцеклеток от родителей, которые пытаются родить, — обычно для ЭКО забирают больше яйцеклеток, чем необходимо, на случай неудач, и они остаются в клинике. Значит, там постоянно есть возможность закалывать инструменты генетического редактирования в зиготы, давать им развиваться до определенной стадии и оценивать эффективность это процедуры».
«Методика состоит из нескольких процедур. Эмбриологические процедуры — работа с эмбрионом, с зиготой, с микроманипулятором, инъекция — могут варьироваться от лаборатории к лаборатории. Хэ, по крайней мере, по его словам в ролике, осуществлял их тем же способом, что и мы в нашей работе», — говорит генетик, проректор Российского национального исследовательского медицинского университета (РНИМУ) имени Пирогова, заведующий лабораторией редактирования генома научного центра имени Кулакова Денис Ребриков. Ранее научная группа под его руководством провела практически такой же эксперимент с человеческими эмбрионами, с той только разницей, что отредактированные яйцеклетки не были подсажены матери.
По словам Ребрикова, речь идет о стандартной процедуре лечения мужского бесплодия по протоколу ИКСИ (ICSI, Intracellular Sperm Injection Protocol), применяемой в том случае, когда сперматозоиды слишком неподвижны для зачатия: «Одновременно со сперматозоидом мы микроманипулятором вносим в яйцеклетку смесь для генного редактирования, получая тем самым зиготу», — говорит ученый.
«Для редактирования обычно используют стандартные покупные ферменты типа Cas9. Вариантов ферментов на сегодня довольно много, поэтому нельзя сказать, какой именно фермент использовал Хэ. А вот остальные компоненты реакционной смеси: направляющую фермент гидовую РНК, олигонуклеотиды и специальную «ДНК-заплатку» (фрагмент ДНК, выступающий в качестве шаблона в процессе зашивания) — как правило в каждой лаборатории делают самостоятельно», — продолжает объяснять Ребриков.
Мутация, которую вносили в эмбрионы, также не является совершенно новой. Более того, она не является и искусственной — около одного процента жителей Европе врожденным образом устойчивы к ВИЧ, то есть несут два аллеля этого мутантного гена, а 10 процентов несут один аллель.
«Эта модификация соответствует присутствующему в популяции варианту гена, который представляет собой возникший в процессе эволюции аллель, вариант гена без 32 букв. И в этом есть некое этическое облегчение ситуации, потому что мы не говорим, что мы создали новый аллель, новый вариант гена, который не встречается у людей. Тысячи людей совершенно естественным путем родились и живут именно с таким вариантом гена», — подчеркивает Ребриков.
Насколько это опасно?
Методика уже опробована, но переход из лаборатории к клинической практике — совсем другое дело, и у фармацевтических компаний на это уходят годы, если не десятки лет. С чисто технической стороны дела, для обеспечения безопасности нужно быть уверенным в двух вещах: метод эффективно редактирует целевой участок ДНК, причем это происходит на статистически значимой выборке с малым процентом отказов (редактирование таргетного локуса), и при этом редактированию не подвергаются другие участки генома (нередактирование неспецифичного локуса).
«Учитывая масштабы центра, с которым работал Хэ, эту методику, скорее всего, отрабатывали три-четыре года. Набрали информацию на эмбрионах и, исходя из своих статистических данных, разрешили себе поставить подобного рода эксперимент», — предполагает Волчков.
Сама по себе генетическая терапия ВИЧ — тоже не абсолютная новость. Компания Songamo тестирует этот метод для лечения вируса, но только на соматических, «обычных» клетках, а не стволовых клетках эмбрионов. Дело дошло до клинических испытаний, а это значит, что по проблеме накоплено очень много данных. Это и данные компании, и открытые данные в научных публикациях.
«Этот ген и система таргетирования — они хорошо изучены, китайцы не вслепую это делали, они лишь перенесли эту технологию на редактирование эмбриона, а не соматических клеток», — замечает Волчков.
Однако и он не уверен в стопроцентной правильности проделанной процедуры.
«Что бы я хотел увидеть, чтобы убедиться в корректности работы? Прежде всего, это предварительные эксперименты на клеточных линиях (эмбриональных столовых клеток). Статистически значимое количество экспериментов на эмбрионах с прерванным развитием — допустим, 25-50 случаев, где четко показывается, что редактируется таргетный ген и отсутствует или почти отсутствует неспецифическое таргетирование других аллелей, которые могли бы дать негативный вклад в состояние будущего человека. Лишь после этого можно было бы переходить к следующей фазе», — говорит Волчков.
Но, по его словам, тут возникает вопрос о правовом регулировании подобных экспериментов. «Только регулятор, в данном случае китайский аналог FDA, может установить критерий этого „почти отсутствует». Пока нет критерия, сложно рассуждать, что допустимо, а что недопустимо», — рассуждает ученый.
«Но представим, что этот этап пройден. Дальше я бы хотел видеть испытания на животной модели. Самая близкородственная человеку модель — это человекообразная обезьяна. Если бы генетическое редактирование продемонстрировали сначала на них, а не на человеческих близнецах, это было бы более правильно, — продолжает Волчков. — Тем более, что работы в этой области уже ведутся: в этом году у китайских же ученых вышла статья в Nautre о том, что они клонировали макаку (нечеловекообразную обезьяну), и еще одна — о том, что они отредактировали ее геном».
А вот Хэ и его группа, по-видимому, не хотят тратить время на опыты над обезьянами. «То, что они пропустили эту важную стадию и перешли к экспериментам на людях, говорит не в их пользу», — заключает Волчков.
Вместе с тем, эмбриогенез человека — это высоко саморегулирующаяся система, и если в ней что-то идет не так, то эмбриональное развитие терминируется (происходит выкидыш на той или иной стадии беременности). Впрочем, этот механизм, к сожалению, работает не всегда, замечает ученый. Но если положиться на высокую вероятность его работы, это значит, что сам факт появления девочек на свет подтверждает неповрежденность их генома.
Профессор Сколтеха и университета Ратгерса Константин Северинов отмечает, что выводы о безопасности, строго говоря, можно будет делать, только доведя эксперимент до логического конца: после генетической манипуляции с яйцеклеткой должен родиться ребенок, повзрослеть, произвести на свет собственных детей, прожить более или менее нормальную жизнь. «Так было с овечкой Долли. Успех эксперимента с ней, в частности, заключался в том, что она произвела на свет еще одну овечку. Но у людей срок жизни сравним со сроком жизни исследователей. В этом смысле очень сложно поставить эксперимент, чтобы он соответствовал тому уровню доказательности, который хочется иметь перед тем, как использовать процедуру», — сказал ученый.
Что именно сделано
28 ноября Цзянькуй Хэ выступил с докладом на GeneEdit Summit в Гонконге, где извинился за досрочную «утечку информации» и рассказал про технические детали своей работы (транскрипт доклада и слайды презентации посетители конференции выложили в Твиттере).
Итак, целью работы было внесение в жизнеспособные человеческие эмбрионы природной мутации CCR5-delta32, то есть делеции в 32 нуклеотида, которая нарушает работу гена и защищает ее носителей от заражения ВИЧ.
По словам Хэ, прежде чем редактировать человеческие эмбрионы для трансплантации, они тщательно подобрали направляющую РНК и проверили ее на нежизнеспособных эмбрионах и эмбриональных клеточных линиях. Кроме того, используя подобранную «затравку», сотрудники Хэ вырастили макаку с нужной мутацией в геноме.
Самой важной частью доклада Хэ стал анализ ДНК отредактированных близняшек. После рождения из пуповинной крови девочек выделили ДНК и полностью отсеквенировали их геномы. Кроме того, ДНК была выделена из нескольких других тканей. В результате секвенирования нецелевой активности Cas9 обнаружено не было.
Была ли достигнута заявленная цель? Последовательности белка CCR5 у обеих девочек действительно не совпадают с белком «дикого типа». Однако, судя по всему, нужной мутации (дельта-32) у них тоже нет. На представленном слайде видно, что у одной из девочек в одной копии гена появилась делеция в 15 нуклеотидов, то есть в пять аминокислот, а другая копия осталась нетронутой. Таким образом, белок CCR5 лишился небольшого кусочка, но все еще может быть функциональным.
У ее сестры оказались затронуты обе копии гена — в одной из них небольшая делеция в четыре нуклеотида, а в другой однонуклеотидная вставка. Белок в обоих случаях будет укороченным, но как это повлияет на устойчивость к вирусу, непонятно.
Последовательности CCR5 девочек указывают на то, что редактирование достигло цели лишь частично — направляющая РНК сработала, белок Cas9 внес разрез, но клеточные системы репарации, вместо того чтобы воспользоваться нужной «заплаткой», залечили разрез без всякого разбора. Кроме того, обе девочки, судя по всему, получились «мозаиками», то есть некоторая часть клеток у них осталась неотредактированной.
С этими проблемами ученые сталкивались во всех опубликованных статьях, посвященных редактированию человеческих эмбрионов, и результат первого эксперимента на людях подтверждает: как бы ни было интересно проверить прорывную технологию «в бою», для свершения революции она все же еще недостаточно отработана.
Источник: https://nplus1.ru/material/2018/11/29/genetically-…
Китайское правительство приказало остановить работу создателя CRISPR-детей
Китайское правительство приказало временно приостановить работу группы китайского ученого Цзянькуя Хэ, который в начале этой недели сообщил о рождении первых в мире CRISPR-детей. Об этом со ссылкой на китайское телевидение и государственное агентство Синьхуа сообщают Associated Press и Reuters.
Ученый заявляет, что в ноябре родились близняшки, у которых он попытался создать устойчивость к заражению ВИЧ, отключив ген CCR5. Хэ рассказал о своей работе в интервью Associated Press, научной статьи о его исследовании или независимых подтверждений пока нет. Вместе с тем, его университет, а также больница, которая якобы одобрила исследования Хэ, заявили, что шокированы новостями и проводят собственные расследования. Китайская Национальная комиссия по здравоохранению тоже расследует ситуацию. Хэ, тем временем, объявил, что еще одна участница его исследования уже беременна.
Reuters цитирует агентство Синьхуа, которое со ссылкой на министерства здравоохранения и науки и технологий заявляет, что «соответствующим органам уже отдан приказ временно приостановить научно-исследовательскую работу [в рамках проекта]». По данным AP, китайский замминистра науки и технологий Наньпин Сюй заявил в интервью государственному телевидению CCTV, что его министерство категорически против этого проекта, и назвал действия Хэ и его коллег незаконными и неприемлемыми.
Сам Хэ, как сообщают агентства, покинул Гонконг, где проходил международный саммит по редактированию генома человека, заявив через представителя, что останется в Китае и, в частности, предоставит исходные данные своего эксперимента для независимого анализа.
Подробнее о проекте Хэ и о том, чего нам ждать от такой генетической революции, читайте в нашем материале «Исправленная редакция».












